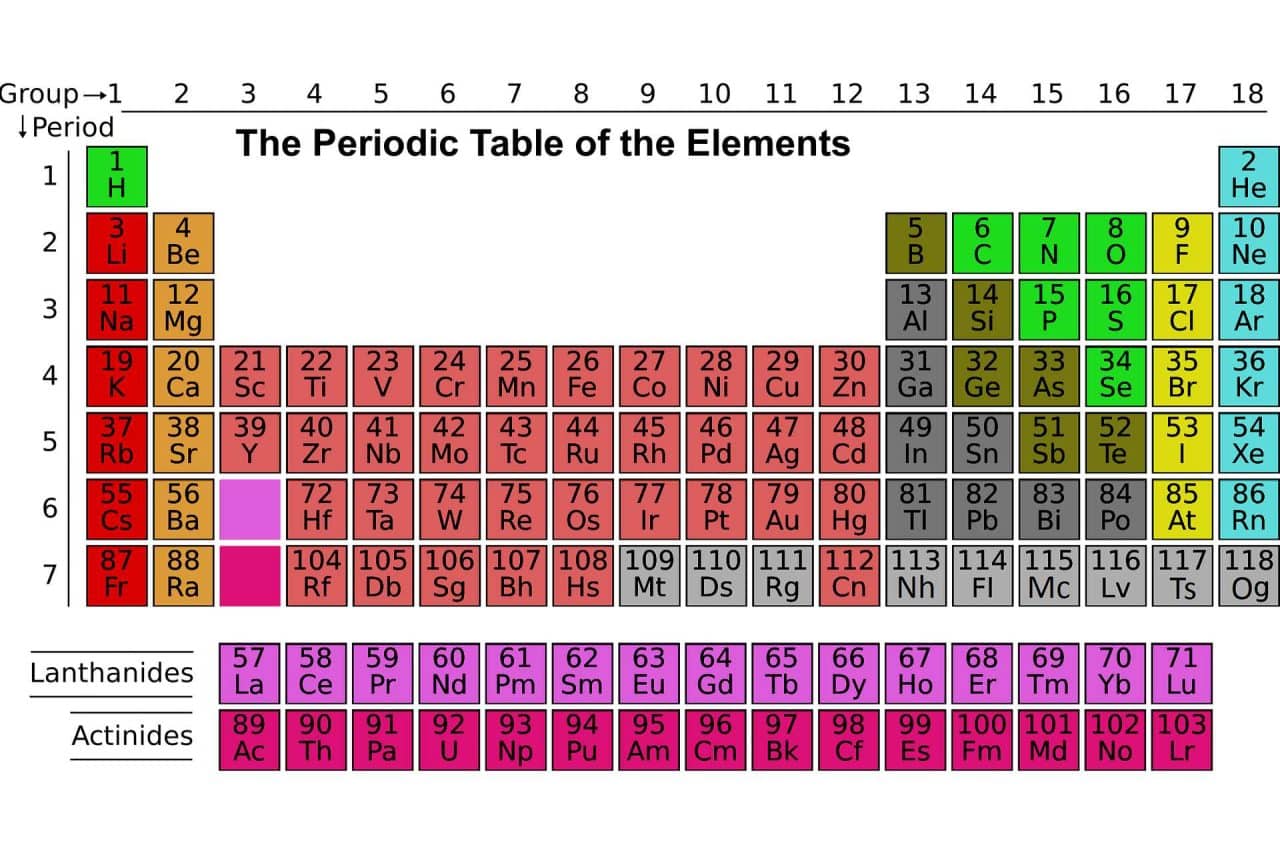
La tabla periódica es un gráfico que resume cuáles son los elementos o ingredientes que existen en el universo. También detalla las propiedades y características principales de dichos elementos y los ordena de modo creciente según sus números atómicos.
Un dato no menor es que estos ingredientes están compuestos por átomos pero no todos tienen los mismos, puesto que esto dependerá de la cantidad de protones que cada uno de ellos incluya. Gracias a los protones es posible darles nombre a los elementos. Por su parte, los electrones hablan sobre la personalidad de los componentes de la tabla periódica.
Podemos decir, asimismo, que la tabla periódica (conocida como la tabla periódica de los elementos) es un esquema que segmenta los elementos químicos de acuerdo a las propiedades que cada uno de ellos posea. Suele utilizarse con frecuencia en muchos campos científicos, sobre todo en aquellos que están relacionados con la química, debido a que analiza las diferencias entre los ingredientes del universo y las combinaciones posibles, además de estudiar sus resultados.
Índice de temas
¿Por qué se llama “tabla periódica”? .
La tabla periódica recibe este nombre por la forma en que se ordenan los elementos dentro del esquema. Es decir, cada cierto periodo o cada cierto número de casillas los componentes se agrupan en nuevas filas, lo que provoca que se formen columnas, llamadas “grupos” o “familias”, donde elementos con propiedades químicas parecidas aparecen juntos.
Entonces, este nombre lo toma de dicha idea de “periodo” transcurrido o de número de casillas. Así es como, en resumidas cuentas, la tabla periódica está organizada de la siguiente manera:
- En el centro: los metales pesados.
- A la izquierda: los metales ligeros.
- A la derecha: los no metales.
Origen de la tabla periódica.
Al origen de la tabla periódica lo encontramos en 1869, cuando el químico ruso Dimitri Mendeléiev publicó esta herramienta gráfica compuesta por 63 elementos, los únicos conocidos hasta ese momento.
Esta primera tabla clasificaba las sustancias según sus masas atómicas y, entre ellas, podía distinguirse una periodicidad relacionada con las propiedades de los elementos. Los mismos fueron clasificados de modo vertical. Con el tiempo, el químico representó los ingredientes pertenecientes a la misma familia de modo horizontal.
El propósito del ruso fue crear una representación coherente que organizara las series químicas que, por aquel entonces, eran 63 de los 118 elementos que hoy se conocen en la naturaleza.
Por su parte, Julius Lothar Meyes, profesor de química alemán, también presentó su propia versión de la tabla periódica en el mismo año. La diferencia con el esquema de Mendeléiev es que Meyes se basó en las propiedades físicas de los átomos.
Ambos científicos organizaron los datos en filas y dejaron “periodos” en blanco para añadir más elementos.
Tiempo después, Mendeléiev lanzó una nueva versión de la tabla periódica, la cual agrupaba los ingredientes de la naturaleza de acuerdo a propiedades que tuvieran en común. Lo hizo ordenándolos en columnas numeradas desde I a VIII, según el estado de oxidación de los elementos.
La tabla periódica que se utiliza en la actualidad corresponde a una versión modificada que el químico americano Horace Groves Deming publicó en 1923. Esta herramienta mejoró las anteriores, ya que organizó los elementos en 18 columnas bien identificadas.
Organización de la tabla periódica.
La tabla periódica de elementos está organizada según filas y columnas. Está compuesta por 118 elementos, los cuales se dividen en:
- 94 elementos presentes en la naturaleza.
- 24 elementos sintéticos (creados artificialmente).
Estos elementos han sido confirmados por la Unión Internacional de Química Pura y Aplicada, IUPAC, sus siglas en inglés.
Siguiendo en el modo en que está organizada la tabla periódica, podemos decir que tiene 7 líneas horizontales, llamadas períodos, y 18 líneas verticales, denominadas grupos o familias. En cada caso, los elementos químicos están organizados según un orden creciente de acuerdo a sus números atómicos. Esto quiere decir que el número atómico crece de izquierda a derecha en la fila de periodo y de arriba hacia abajo en la columna de grupo.

Los grupos de la tabla periódica .
Los grupos de la tabla periódica son 18 en total y están organizados en columnas verticales. Están numerados del 1 al 18 y se leen de izquierda a derecha. De esta forma, se comienza por los metales alcalinos y se termina con los gases nobles. Aquellos elementos que están en una misma columna comparten similitudes químicas.
Grupo 1 (IA)
Los metales alcalinos:
- Litio (Li)
- Sodio (Na)
- Potasio (K)
- Rubidio (Rb)
- Cesio (Cs)
- Francio (Fr)
- Hidrógeno (H)
Grupo 2 (IIA)
Los metales alcalinotérreos:
- Berilio (Be)
- Magnesio (Mg)
- Calcio (Ca)
- Estroncio (Sr)
- Bario (Ba)
- Radio (Ra)
Grupo 3 (IIIB)
La familia del escandio:
- Itrio (Y)
- Lantano (La)
- Cerio (Ce)
- Praseodimio (Pr)
- Neodimio (Nd)
- Prometio (Pm)
- Samario (Sm)
- Europio (Eu)
- Gadolinio (Gd)
- Terbio (Tb)
- Disprosio (Dy)
- Holmio (Ho)
- Erbio (Er)
- Tulio
- Iterbio (Yt)
- Lutecio (Lu)
- Actinio (Ac)
- Torio (Th)
- Protactinio (Pa)
- Uranio (U)
- Neptunio (Np)
- Plutonio (Pu)
- Americio (Am)
- Curio (Cm)
- Berkelio (Bk)
- Californio (Cf)
- Einstenio (Es)
- Fermio (Fm)
- Mendelevio (Md)
- Nobelio (No)
- Lawrencio (Lr)
Grupo 4 (IVB)
La familia del titanio:
- Circonio (Zr)
- Hafnio (Hf)
- Rutherfordio (Rf)
Grupo 5 (VB)
La familia del vanadio
- Niobio (Nb)
- Tántalo (Ta)
- Dubnio (Db)
Grupo 6 (VIB)
La familia del cromo:
- Molibdeno (Mb)
- Wolframio (W)
- Seaborgio (Sg)
Grupo 7 (VIIB)
La familia del manganeso:
- Renio (Re)
- Tecnecio (Tc)
- Bohrio (Bh)
Grupo 8 (VIIIB)
La familia del hierro:
- Rutenio (Ru)
- Osmio (Os)
- Hassio (Hs)
Grupo 9 (VIIIB)
La familia del cobalto:
- Rodio (Rh)
- Iridio (Ir)
- Sintético meitnerio (Mt)
Grupo 10 (VIIIB)
La familia del níquel:
- Paladio (Pd)
- Platino (Pt)
- Sintético darmstadtio (Ds).
Grupo 11 (IB)
La familia del cobre:
- Plata (Ag)
- Oro (Au)
- Sintético roentgenio (Rg)
Grupo 12 (IIB)
La familia del zinc:
- Cadmio (Cd)
- Mercurio (Hg)
- Sintético copernicio (Cn)
Grupo 13 (IIIA)
Los térreos:
- Boro (Br)
- Aluminio (Al)
- Galio (Ga)
- Indio (In)
- Talio (Tl)
- Sintético nihonio (Nh)
Grupo 14 (IVA)
Los carbonoideos:
- Carbono (C)
- Silicio (Si)
- Germanio (Ge)
- Estaño (Sn)
- Plomo (Pb)
- Sintético flevorio (Fl)
Grupo 15 (VA)
Los nitrogenoideos:
- Nitrógeno (N)
- Fósforo (P)
- Arsénico (As)
- Antimonio (Sb)
- Bismuto (Bi)
- Sintético moscovio (Mc)
Grupo 16 (VIA)
Los calcógenos o anfígenos:
- Oxígeno (O)
- Azufre (S)
- Selenio (Se)
- Teluro (Te)
- Polonio (Po)
- Sintético livermorio (Lv)
Grupo 17 (VIIA)
Los halógenos:
- Flúor (F)
- Cloro (Cl)
- Bromo (Br)
- Yodo (I)
- Astato (At)
- Sintético teneso (Ts)
Grupo 18 (VIIIA)
Los gases nobles:
- Helio (He)
- Neón (Ne)
- Argón (Ar)
- Kriptón (Kr)
- Xenón (Xe)
- Radón (Rn)
- Sintético oganesón (Og)

Los periodos de la tabla periódica.
Los periodos de la tabla periódica están representados en siete filas horizontales, en ellas se encuentran los elementos cuyo número de capas de electrones es igual al número del período.
Se pueden identificar tres categorías de elementos según sus propiedades químicas y físicas:
- Metales: elementos sólidos a temperatura ambiente, maleables y buenos conductores de calor y electricidad. Están del lado izquierdo de la tabla.
- No metales: son gases y también líquidos, no conducen electricidad. Están del lado derecho de la tabla.
- Metaloides: también denominado semimetales. Tienen propiedades de los dos anteriores, son brillantes, pero pueden presentarse opacos. Son poco dúctiles. Tienen conductividad eléctrica. Se encuentran entre los metales y los no metales, en el lado derecho de la tabla periódica.
Los bloques de la tabla periódica.
Los bloques de la tabla periódica son cuatro y se organizan de acuerdo a la secuencia de capas de electrones de cada elemento químico.
- Bloque s: compuesto por los grupos 1 y 2.
- Bloque p: compuesto por los grupos que van del 13 al 18 y metaloides.
- Bloque d: compuesto por los grupos del 3 al 12 y los metales denominados de transición.
- Bloque f: compuesto por los lantánidos y actínidos.
Citar este artículo
Navicelli, V. (9 de noviembre de 2022). Definición de tabla periódica . Por qué se llama así, origen y organización. Definicion.com. https://definicion.com/tabla-periodica/



