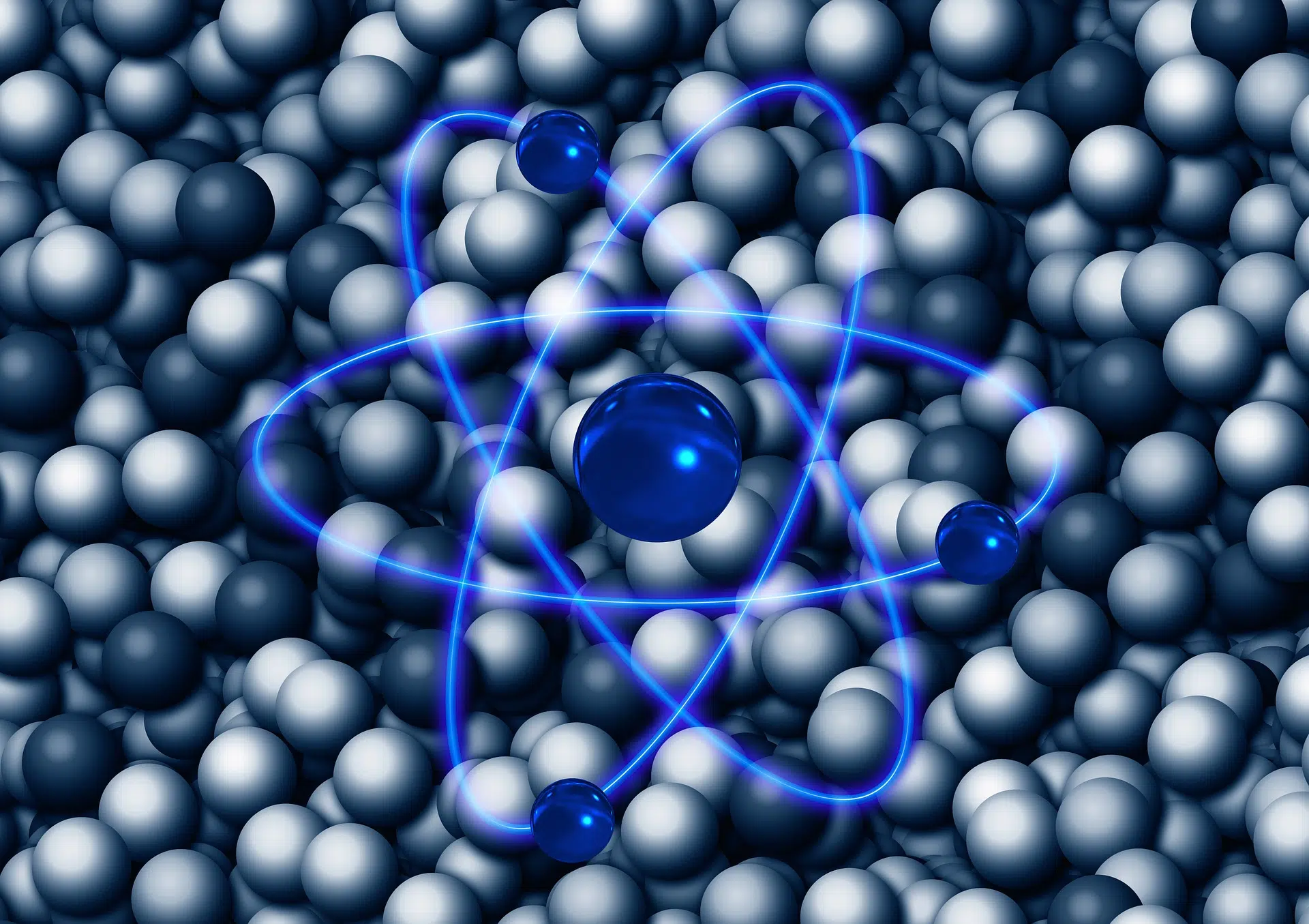
El átomo es la menor porción de materia posible. Es la pieza esencial de toda la materia viva y no viva.
Básicamente, la materia está constituida por combinaciones de elementos. Hasta la actualidad, se han clasificado noventa y dos elementos químicos existentes en nuestro planeta -y veintiséis más obtenidos en laboratorio-, tales como el carbono, el oxígeno, el calcio, entre otros.
Estos elementos, que en total suman ciento dieciocho, se encuentran enumerados en la tabla periódica de elementos y se definen como formas esenciales de la materia que tienen masa y ocupan un espacio.
Los átomos son las unidades más pequeñas en que estos elementos pueden dividirse sin perder las propiedades específicas que los caracterizan, es decir, antes de dejar de ser un elemento determinado.
Por ejemplo, podemos romper en pedacitos ínfimos un trozo de cualquier material, como el aluminio, y la porción más pequeña -aunque sea polvo o hasta un único átomo- seguirá siendo aluminio.

Índice de temas
Estructura del átomo.
Justamente, la etimología de la palabra átomo proviene del griego átomos, que significa “indivisible”. Claro que, en la actualidad, sabemos que los átomos contienen partículas más pequeñas aún, denominadas protones, neutrones y electrones.
La estructura interna del átomo comprende un núcleo central -que supone casi la totalidad de la masa atómica-, dentro del cual se encuentran los protones y los neutrones. A su vez, cuenta con al menos un electrón ubicado fuera del núcleo, en constante y veloz movimiento en trono a él.
Los electrones son subpartículas cargadas negativamente, las cuales determinan las propiedades químicas de un átomo y tienen que ver con la energía dentro del mismo. El comportamiento químico del átomo depende de la cantidad de electrones y de su distribución en el espacio. Según la ubicación de los electrones respecto del núcleo, varía la cantidad de energía que contienen.
Como dijimos, el núcleo de los átomos está constituido por protones, de carga positiva, y neutrones, sin carga eléctrica. El número de de protones es igual al número de electrones, y determina el número atómico. El peso atómico se define sumando el número de protones y de neutrones que existen en el núcleo.
Los átomos de un determinado elemento cuentan con la misma cantidad de protones en el núcleo. Pero, a veces el número de neutrones puede variar. Lo que sucede en estos casos, entonces, es que los átomos cuentan con el mismo número atómico (mismo número de protones y de electrones) pero difieren en el peso (distinto número de neutrones en cada átomo). Estos átomos se denominan isótopos de determinado elemento. Los elementos suelen tener diversas formas isotópicas.
Enlaces entre átomos.
Los átomos entran en interacción mutua, formando nuevas y mayores partículas: las moléculas. Constituidas por dos o más átomos, de iguales o diferentes elementos, las moléculas se mantienen unidas por fuerzas o enlaces químicos, a partir de los cuales los átomos comparten o intercambian electrones.
Los enlaces químicos pueden ser débiles o fuertes, lo cual dependerá de la energía que se necesite para romperlos. Los enlaces más comunes son los iónicos y los covalentes.
Los enlaces iónicos son enlaces débiles que se dan entre átomos eléctricamente cargados llamados iones, los cuales se forman cuando un electrón salta de un átomo a otro. Estos enlaces suponen la atracción electrostática entre iones con carga eléctrica opuesta.
Por su parte, los enlaces covalentes son fuertes y protagonizan la mayoría de las uniones entre átomos que forman moléculas. Estos últimos implican el intercambio de pares de electrones entre átomos con equilibrio estable de fuerzas atractivas y repulsivas entre ellos. En este tipo de enlaces un átomo comparte un par de electrones con otro átomo, y dicho par forma un orbital molecular que contiene a los núcleos de los dos átomos.
Los enlaces químicos se rompen formando nuevos enlaces. Esto se llama reacción química, en dicho proceso los átomos intercambian electrones. A grandes rasgos, existen tres tipos de reacciones químicas:
- Dos o más sustancias que se combinan para formar una sustancia diferente.
- Una sustancia se disocia en dos o más sustancias.
- Dos o más sustancias intercambian átomos.
Un compuesto químico es una sustancia constituida por átomos formados por dos o más elementos diferentes. El 99% de la totalidad de la materia viva está constituida por seis elementos químicos: carbono (C), hidrógeno (H), nitrógeno (N), oxígeno (O), fósforo (P) y azufre (S). Los átomos de estos elementos forman enlaces covalentes, dando lugar a moléculas complejas.

Historia del átomo.
La noción de que la materia se encuentra constituida por múltiples partículas y que, por ende, puede ser dividida en porciones cada vez más pequeñas hasta llegar a una unidad indivisible, surge en el siglo V a.C, en la antigua Grecia, de la mano del filósofo Leucipo de Mileto.
Un discípulo de Leucipo llamado Demócrito profundiza el planteo de su maestro y utiliza el término átomos para designar a estas unidades indivisibles de materia. Pero esta visión es negada por Aristóteles, quien se inclinaba más por la posibilidad de división infinita de la materia, y opta por mantener la concepción establecida por Empédocles sobre la existencia de cuatro elementos constituyentes de la misma (agua, fuego, tierra y aire). Y fue esta idea -que proponía que todas las cosas estaban formadas por una combinación de estos cuatro elementos- la que tuvo preponderancia durante los siguientes dos mil años.
A comienzos del siglo XIX, el naturalista británico John Dalton retoma la idea de la materia constituida por átomos indivisibles; avanza la teoría afirmando que éstos no se transforman ni se destruyen, y destaca la igualdad entre átomos de un mismo elemento. Además, afirma que los átomos constituidos por distintos elementos químicos -a diferencia de Demócrito que creía que todos los átomos estaban formados por el mismo material y solo diferían en forma y tamaño- se combinan para formar compuestos químicos.
A finales del siglo XIX el científico británico Michael Faraday descubre una relación entre electricidad y materia, y sugiere que el átomo no es una partícula indivisible. Años más tarde, el modelo atómico del físico británico Joseph John Thomson cuestiona la propuesta de Dalton porque este último no daba cuenta del átomo con una organización en su interior.
En contraste, Thomson describe la estructura interna del átomo con electrones cargados negativamente, ubicados uniforme y estáticamente en una esfera de carga positiva. Al poco tiempo se descubriría que en realidad los electrones se mueven a grandes velocidades -cercanas a la velocidad de la luz- alrededor del núcleo central del átomo (el cual cuenta con carga positiva).
Los físicos norteamericanos Murray Gell-Mann y Georg Zweig descubren, en la década de 1960, una partícula subatómica fundamental: el quark. Las partículas subatómicas continúan estudiándose en la actualidad para alcanzar mayor claridad sobre cómo se constituye la materia.
Citar este artículo
Lehrer, L. (11 de enero de 2022). Definición de átomo. Su estructura, historia y enlaces entre átomos. Definicion.com. https://definicion.com/atomo/